2017年成为CAR-T技术的标志性元年------FDA先后批准两款CAR-T细胞治疗产品Kymriah和Yescarta上市, 开启了肿瘤免疫治疗的新时代。在此推动下,我国也先后**了两项重要政策,一个是2017年12月, 国家食品药品监督管理总局组织制定了《细胞治疗产品研究与评价技术指导原则(试行)》, 另一个是2018年6月,中国食品药品检定研究院发布了关于《CAR-T细胞治疗产品质量控制检测研究及非临床研究考虑要点》的通知, 为我国CAR-T细胞产品的质量控制研究及非临床评价研究提供更加具体的技术指导,从而使细胞免疫治疗走上了更加严格的规范化道路, 并与国际接轨。
越来越多的临床试验结果证实了CAR-T细胞免疫治疗的效力, 特别是血液病方面, 如白血病, 淋巴瘤。而在实体瘤的治疗方面仍需要不断努力。此外,新型的CAR-T技术也不断涌现, 如双特异CAR, 通用CAR等。临床医生和生物技术公司也在不断积极推动CAR-T细胞免疫治疗走向临床应用。目前中国是世界上申请细胞治疗临床试验仅次于美国的国家。
除了CAR-T, TCR-T, CAR-NK等新型细胞免疫治疗也正在开发中。为此,生物谷将在上海隆重举办2018(第四届)下一代CAR-T & TCR-T研讨会, 邀请国内外知名的专家,学者,临床医生座谈,推动细胞免疫治疗技术的临床应用及规范化治疗。同期会特举办自动化细胞培养主题沙龙和CAR-T 细胞治疗的CDMO模式主题沙龙。
会议安排
会议时间:11月23日-24日
会议地点:上海
主办单位:生物谷(上海春谷生物医药科技有限公司)
会议形式:一个会议+ 二个沙龙+展览展示
会议规模:400人
会议亮点
1.与专家讨论CAR-T, 到TCR-T, NK细胞免疫治疗技术在科研和应用领域的问题;
2.新的细胞治疗政策解读,使细胞治疗企业有“规”可循;
3.推动临床研究,如何提高安全性是重点。
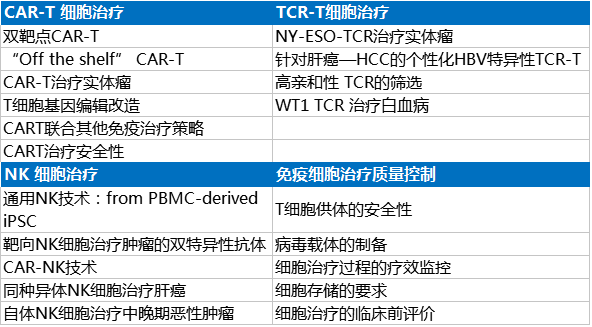
会议讨论重点
|
讨论问题 |
Vs |
会议干货之一 |
|
1.CART安全问题依然存在, 主要是细胞因子风暴 (Cytokine storm release, CSR)、脱靶和神经毒性 |
1.设计带安全开关的CAR-T |
|
|
2.实体瘤治疗没有取得有效的临床进展 |
2.选择肿瘤新抗原; TCR-T; NK |
|
|
3.疾病复发率比较高 |
3.双肿瘤抗原CAR-T |
|
|
4.T细胞生产成本高 |
4.通用CAR-T; 改进生产工艺 |
会议议题
已确认嘉宾;

拟邀嘉宾(排名不分先后)

参会及媒体合作:
姚毅
Mt: 17321087523
E-mail:yi.yao@bioon.com
官网:http://meeting.bioon.com/2018CAR-T/reg-without-login?__token=aiaiyi


